日前,据家药监局药品审评中心(CDE)官网信息显示,合源生物递交的CAR-T产品赫基仑赛注射液(拟定)的上市申请已获得受理,适应症为用于治疗或难治性B细胞型急性淋巴细胞白血病(r/r B-ALL)患者。
据了解,赫基仑赛注射液(CNCT19细胞注射液,Inaticabtagene Autoleucel)是一款靶向CD19的CAR-T细胞治疗药物产品,其具有独特的CD19 scFv(HI19a)结构,是合源生物首个核心产品,由于前期的积极临床疗效,此前,赫基仑赛注射液已被国家药监局纳入突破性治疗药物品种,并被美国FDA授予孤儿药资格。
在日前举行的第64届美国血液学会(ASH)年会上,合源生物首次公布了赫基仑赛注射液用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病(r/r B-ALL)关键性临床研究数据。
数据显示,截至2022年9月27日,39例成人r/r B-ALL患者接受了赫基仑赛注射液回输,细胞产品制备成功率100%,入组患者包含多项预后不良特征,包括难治患者比例高、肿瘤负荷高、携带与ALL预后不良密切相关的异常基因。试验数据显示:在39例接受赫基仑赛注射液回输的患者中,有32例患者达到缓解,3个月内的ORR为82.1%,其中CR率达66.7%(26/39);在39例接受赫基仑赛注射液回输的患者中,经IRC评估有25例患者达到缓解,3个月时的ORR为64.1%,其中CR率达51.3%(20/39);3个月时和3个月内达CR或CRi患者中微小残留病灶(MRD)阴性率分别为92.0%和100%;
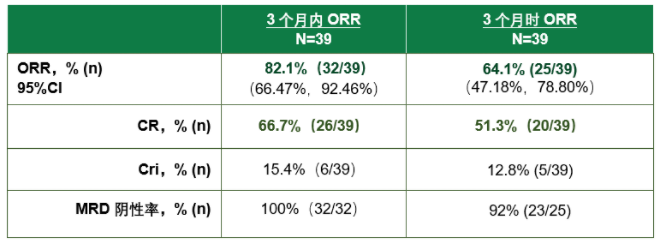
赫基仑赛注射液有效性数据总结图片来源:合源生物官微
同时,数据还显示,接受赫基仑赛注射液治疗后,达到缓解(CR/CRi)的患者,显示出可获得持久的缓解,延长的无复发生存期和总生存期;对于回输后3个月时仍处于CR/CRi的患者(N=25),其DOR、RFS和OS显示出进一步延长趋势;后续是否接受移植对于DOR、RFS和OS无明显影响,即患者后续无论是否接受移植,均能表现出持续缓解和长期生存获益;
缓解持续时间(DOR)方面,中位随访9.3个月,中位DOR未达到,预计12个月DOR率为66.7%,3个月时达到CR/CRi患者中12个月DOR率达80%;至数据截止日,在无后续造血干细胞移植的情况下,最长持续缓解时间已超过18个月,患者仍处于持续缓解中,并且在体内可检测到赫基仑赛细胞长期存续。
中位随访8.0个月,中位RFS和OS均未达到;3个月内达到CR/CRi患者中(N=32),预计12个月RFS率和OS率分别达64.4%和72.0%;3个月时达到CR/CRi患者中(N=25),预计12个月RFS率和OS率分别为80.0%和85.6%。
安全性方面,在39例受试者中,33例受试者发生细胞因子释放综合征(CRS),大部分为1~2级CRS,仅4例受试者为3级及以上CRS;在39例受试者中,4例受试者发生免疫效应细胞相关神经毒性综合征(ICANS),仅3例受试者发生3级及以上ICANS;所有≥3级CRS和ICANS均得到缓解,无CRS/ICANS相关死亡事件发生;无非预期靶向CD19 CAR-T治疗导致的不良事件发生。
急性B淋巴细胞白血病(B-ALL)是常见的血液恶性肿瘤之一,成人患者较儿童患者整体生存更差。成人B-ALL初治后复发率高,约60%的患者最终会进展到r/r B-ALL。r/r B-ALL患者预后极差,临床缺乏有效治疗手段,生存期仅2-6个月,中国患者近30年生存无显著改善。成人r/r B-ALL严重危及生命,存在巨大的未被满足的临床需求,截止目前,中国尚未有治疗成人r/r B-ALL的CAR-T产品获批上市。
来源:医谷网
免责声明
本文来源为其他媒体的内容转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。